Un grupo de investigadores del CSIC han dado un paso más para saber cómo funciona una de las proteínas clave para que proliferen muchas bacterias, entre ellas la muy conocida Escherichia coli. Coordinado desde el Centro Nacional de Biotecnología por Miguel Vicente, el principal objetivo de este proyecto es el de encontrar nuevos antibióticos y, para ello, estudian las propiedades de FtsZ, la proteína que inicia el proceso por el que una bacteria se divide en dos.
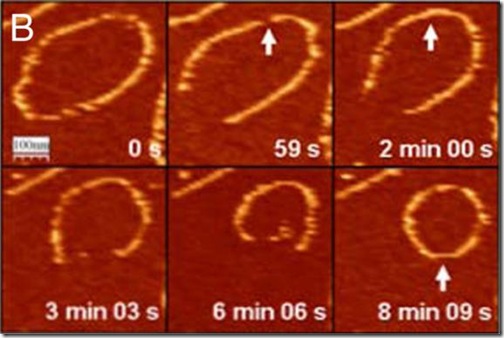
Marisela Vélez, del Instituto de Catálisis y Petroleoquímica, también del CSIC, ha utilizado un microscopio de fuerza atómica, que permite observar con enorme detalle muestras sumergidas en una gota de líquido, para estudiar FtsZ. Sus observaciones han desvelado detalles muy importantes sobre cómo los polímeros de FtsZ, que son esenciales para la división de la bacteria, se curvan sobre una superficie de mica, llegando a formar círculos. Precisamente en la célula, FtsZ se localiza en el sitio donde se produce la división formando un anillo de mayores dimensiones que al estrecharse acaba por separar a las dos células.
Sobre la superficie de mica, los polímeros de FtsZ se estabilizan de forma transitoria, pero con el tiempo se van reduciendo de diámetro y los círculos se desvanecen. Esto ocurre porque las moléculas que componen el círculo se salen de él al azar, aunque las que se encuentran en los extremos lo hacen aún con mayor frecuencia. Según razonan los investigadores, si este proceso no existiese, los anillos difícilmente se estrecharían y la bacteria no se dividiría. El truco empleado para poder estudiar la formación y desaparición de los círculos ha sido utilizar unas condiciones bioquímicas que permiten ralentizar la separación de las moléculas de FtsZ que los componen. De este modo han podido estudiar este proceso con mayor precisión.
No cabe duda de que los compuestos que bloqueen por completo el proceso de formación o el de disgregación de los círculos de FtsZ inutilizarán el anillo de división en la bacteria impidiéndole su proliferación. En el 2009, David Haydon del Begbroke Science Park y su equipo encontraron una molécula (PC190723) que se une y bloquea la acción de la FtsZ, evitando la proliferación de la bacteria de manera similar a como lo hace el Taxol® con la tubulina en el tratamiento del cáncer. Por ello, los investigadores quieren seguir colaborando con las empresas biotecnológicas que participan en el proyecto hasta encontrar un nuevo antibiótico.
En el trabajo, publicado en PNAS ha requerido una notable integración de diversos conocimientos y técnicas. De hecho, en estas investigaciones han participado el grupo del Centro de Investigaciones Biológicas dirigido por Germán Rivas, científicos del Instituto de Ciencia de Materiales Nicolás Cabrera y el investigador del Departamento de Física Teórica de la Materia Condensada de la Universidad Autónoma de Madrid Pedro Tarazona.
Fuente | CNB-CSIC.
Referencia:
Mateos-Gil P, Paez A, Hörger I, Rivas G, Vicente M, Tarazona P, Vélez M. Depolymerization dynamics of individual filaments of bacterial cytoskeletal protein FtsZ. PNAS 109(21):8133-8138. doi: 10.1073/pnas.1204844109





0 comentarios:
Publicar un comentario
Se respetuoso con tus comentarios y críticas. Cualquier comentario ofensivo será eliminado.