Imagina que el pie de atleta matara. Que cada año miles de personas en el mundo fallecieran a causa de esta enfermedad. Que constantemente debas aplicarte tu Hongocid® entre los dedos del pie para evitar la muerte. Bueno, algo así es lo que ocurre con la papa. Un hongo llamado Phytophthora infestans es capaz de acabar con los sembríos de este importante cultivo en un par de semanas.
 |
| Phytophthora infestans. Fuente: Wikimedia Commons |
Me dicen el hongo asesino, me dicen el hongo bien latino (8)
P. infestans es un hongo que produce una enfermedad conocida como el tizón tardío (de cariño, la “rancha”). Este hongo fue responsable de una de las peores hambrunas de la historia europea que, entre los años 1845 y 1849, acabó con todas las cosechas de papa de Irlanda y de algunas otras regiones de Europa. Un millón de personas perdieron la vida y otro millón migró hacia Norteamérica. Si viste la película “Pandillas de Nueva York”, ahora entenderás de dónde salían tantos irlandeses.
Este hongo se originó en los andes peruanos y llegó al viejo continente durante la colonia. Para que se desarrolle adecuadamente requiere de climas templados (12ºC - 15ºC) y húmedos (90% de humedad relativa), al menos por dos días consecutivos. Si se dan estas condiciones, es necesario aplicar inmediatamente el fungicida porque una vez que el hongo se desarrolla en la planta, es imposible eliminarlo.
Carrera armamentista
No todas las papas son susceptibles al ataque de P. infestans. Existen variedades y especies silvestres que de manera natural son resistentes al ataque de este hongo. ¿Cómo lo hacen? Pues, para entenderlo, hablaremos un poco sobre la coevolución de un patógeno con su hospedero.
Por lo general, los agentes patógenos, sea cual sea su naturaleza (una bacteria, un virus, un hongo, etc.), atacan de manera específica a un determinado organismo, al cual llamaremos hospedero. El hospedero, por su parte, ha evolucionado la capacidad de reconocer a estos patógenos a través de las moléculas presentes en su superficie, para así activar oportunamente un mecanismo de defensa.
Hasta ahí todo bien. Pero los patógenos no se quedan con los brazos flagelos o hifas cruzadas. Ciertas mutaciones en su ADN pueden provocar ligeros cambios en la estructura de las moléculas presentes en su superficie, evitando así ser reconocidos por los hospederos. No obstante, el hospedero desarrollará nuevos receptores —o modificará los existentes— para que sean capaces de reconocer a los patógenos nuevamente. Y así el ciclo se repite una y otra vez, por los siglos de los siglos.
Otra estrategia empleada por los patógenos para lograr su cometido es producir moléculas que se infiltran en el hospedero y bloquean, desde adentro, su mecanismo de defensa. A estas moléculas se les conoce como efectores. Para entenderlo mejor, es como esparcir un potente somnífero a través del conducto de ventilación de una base militar para que todos los vigilantes se duerman y así el enemigo pueda ingresar al cuartel sin problemas. Pero el hospedero también cuenta con un as bajo la manga: uno o más genes de resistencia que sólo se activan ante la presencia de los efectores.
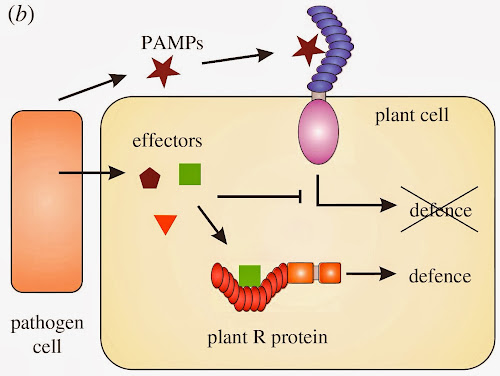 |
| Modo de acción de los efectores y genes de resistencia. |
En resumidas cuentas, esto es una carrera armamentista: el patógeno desarrolla nuevos mecanismos de infección y el hospedero nuevas formas de defenderse.
Préstame tus genes
En el 2009 se determinó la secuencia del genoma de P. infestans y, en el 2011, del genoma de la papa. Lo interesante de estos estudios fue que se identificaron al menos 563 efectores y 438 genes de resistencia, respectivamente. El problema es que en la mayoría de las zonas productoras de papas se cultivan unas pocas variedades mejoradas, todas genéticamente idénticas, que reducen el repertorio de genes de resistencia que podrían estar presentes. Esto favorece a P. infestans que rápidamente encuentra la forma de evadir su mecanismo de defensa, acabando así con toda la cosecha.
La mayor parte de los genes de resistencia se encuentran en las especies silvestres. Los fitomejoradores han tratado de pasar estos genes a las variedades comerciales pero con poco éxito debido a que estas no se pueden cruzar fácilmente: las papas cultivadas tienen cuatro copias de su ADN (tetraploides), mientras que las silvestres solo dos (diploides). Además, en los cruces no sólo se traspasan los genes “buenos” de las especies silvestres, sino también los “malos”, provocando que las variedades mejoradas pierdan sus combinaciones favorables de genes. Una forma de traspasar los genes “buenos” de una especie a otra es mediante la ingeniería genética.
Es así que un grupo de investigadores ingleses, liderados por el Dr. Jonathan Jones del Sainsbury Laboratory, han desarrollado una papa transgénica de la variedad Desiree capaz de resistir el ataque de P. infestans utilizando los genes de resistencia de sus parientes silvestres. Los resultados aparecen publicados esta semana en Philosophical Transactions of the Royal Society B.
Los primeros ensayos
En primer lugar, Jones y su equipo aislaron los genes de resistencia Rpi-vnt1.1 de Solanum venturii —papa silvestre originaria de Argentina— y Rpi-mcq1 de Solanum mochiquense —originaria de Perú— y los introdujeron, por separado, en la variedad Desiree. Las papas transgénicas resultantes no mostraron diferencias visuales con respecto a sus contrapartes no transgénicas, ni tampoco diferencia en los rendimientos cuando fueron cultivadas en zonas libres del patógeno.
Luego, una vez obtenido el permiso para realizar los experimentos controlados en campo, se propusieron a sembrar 192 plantas transgénicas cada año (2010 - 2012) agrupadas en bloques, para evaluar su respuesta ante el ataque de P. infestans.
Durante el primer año (2010), las condiciones climáticas no fueron las adecuadas para el desarrollo del patógeno. Las temperaturas de junio y julio estuvieron muy bajas y la humedad relativa nunca alcanzó el 90%. A mediados de agosto, las condiciones para el desarrollo del hongo mejoraron y empezaron a aparecer los primeros síntomas de la rancha. Tres semanas después, las papas transgénicas Rpi-vnt1.1 redujeron la severidad de la enfermedad entre un 50% y 80%. La otra papa transgénica (Rpi-mcq1) no funcionó y se infectó completamente al igual que la papa no transgénica (control). Sin embargo, como la enfermedad llegó bastante tarde, los tubérculos ya se habían desarrollado por lo que no hubo diferencia en el rendimiento entre las lineas transgénicas y el control.
Para el segundo año de experimentación se dejó de lado la línea transgénica que no funcionó. Las condiciones climáticas fueron menos favorables aún —para el patógeno— que en el año anterior. La rancha no apareció hasta la primera semana de septiembre, cuando las plantas ya estaban en la etapa de senescencia (envejecimiento). En este caso, tanto la línea transgénica como el control se vieron infectadas por el hongo en un 95% a 100%. Esto indicaría que las plantas se vuelven más susceptibles a la rancha en la senescencia, sea o no transgénica. Pero eso no importa, porque los tubérculos ya se habían formado y los rendimientos fueron los mismos.
Fue una lástima que los dos primeros años de estudio no dieran resultados promisorios. Hasta este punto no se sabía realmente si la línea transgénica era resistente a la rancha y podía evitar la pérdida del cultivo. Pero así es la ciencia, no todo es ¡Eureka!
A la tercera, la vencida
Por suerte, en el último año de estudio se dieron todas las condiciones climatológicas favorables para el desarrollo del patógeno. De hecho fue el quinto verano más húmedo de los últimos 100 años. A mediados de julio aparecieron los primeros síntomas de la rancha y, un mes después, la enfermedad atacó al 100% de las papas no transgénicas y su rendimiento cayó en un 50% a 75%, cosa que no ocurrió con la línea transgénica.
 |
| Izquierda: papa transgénica. Derecha: control atacado por P. infestans |
Si bien es cierto que los datos no prueban que la introducción del gen Rpi-vnt1.1 es suficiente para proteger a la papa de la rancha en condiciones no controladas de un campo de cultivo, el trabajo es un gran avance hacia el desarrollo de una línea transgénica de papa que sea genéticamente estable y que no se haya visto alterada su funcionalidad, algo que sí ocurrió con la primera papa transgénica resistente a insectos, NewLeaf®, desarrollada en los años 1990 por Monsanto. En aquel caso, la transformación genética volvió susceptible a la planta contra una plaga de nemátodos.
No debemos olvidar que P. infestans cuenta con una gran cantidad de efectores que le permiten sortear las defensas de las variedades mejoradas de papa. Sin embargo, existen efectores que se mantienen constantes (conservados) en variedades del patógeno porque realizan funciones vitales para el organismo. Encontrar genes de resistencia para estos efectores indispensables prolongaría la protección del cultivo porque el patógeno tardaría más tiempo en encontrar un reemplazo funcional para este efector.
Y para concluir, debemos recalcar que el Perú cuenta con decenas de especies silvestres de papas y cientos de variedades nativas que están a la espera de que algún día aprovechemos su riqueza genética. Lo primero es hacer estudios de bioprospección para identificar y caracterizar genes de resistencia para ser utilizados en el mejoramiento de nuestras variedades comerciales a través de la ingeniería genética.
Referencia:
Jonathan D. G. Jones, Kamil Witek, Walter Verweij, Florian Jupe, David Cooke, Stephen Dorling, Laurence Tomlinson, Matthew Smoker, Sara Perkins, & Simon Foster (2014). Elevating crop disease resistance with cloned genes Philosophical Transactions of the Royal Society B DOI: 10.1098/rstb.2013.0087
BioUnalm









