De cada 100 pacientes diagnosticados con cáncer de tiroides, 97 logran vivir más de cinco años; pero si ese mismo número de pacientes es diagnosticado con cáncer de páncreas, tan solo cinco lo harán. ¿A qué se debe?
Red bioquímica
Siento decirlo, pero nunca escucharemos tal cosa como “se ha encontrado la cura para el cáncer”. El cáncer no es una enfermedad única que se presenta de la misma manera en todos los tejidos y órganos del cuerpo. Cada uno tiene su propia peculiaridad y su forma de tratamiento.
Esto se debe a que cada una de nuestras células engloba una intrincada red de reacciones bioquímicas coordinadas sumamente compleja y estructurada, que se diferencia de las demás dependiendo de los genes que se encuentren encendidos o apagados, agrupándose con otras similares a ella para formar los tejidos que constituyen cada órgano de nuestro cuerpo.
Considerando esto, podemos decir que el comportamiento de las células cancerosas está gobernada y coordinada por una red de señalización bioquímica, que traduce las señales externas —hormonas, factores de crecimiento o estrés fisiológico— en respuestas bioquímicas apropiadas, tales como el crecimiento, proliferación, diferenciación o muerte celular, que conducen al desarrollo de tumores y su diseminación hacia tejidos sanos (metástasis).
Entonces, el cáncer debe ser estudiado como un sistema, donde el producto de expresión de un simple gen mutado, por ejemplo: un factor de transcripción (también conocido como interruptor genético), puede afectar distintas redes bioquímicas, pudiendo desencadenar una proliferación celular descontrolada.
Esta complejidad bioquímica y metabólica limita nuestro entendimiento sobre la enfermedad. Desconocemos por qué ciertos virus pueden desencadenar el desarrollo de un cáncer, o cuál es el mecanismo de acción de ciertos agentes terapéuticos o —volviendo a la pregunta original de este post— por qué la probabilidad de supervivencia de un paciente depende del tipo de cáncer que le han diagnosticado.
Un grupo de investigadores liderados por el Dr. Jack Tuszynski del Departamento de Oncología de la Universidad de Alberta (Canadá), ha estudiado las redes bioquímicas de 14 tipos de cáncer encontrando una relación inversa entre su grado de complejidad y la probabilidad de supervivencia a 5 años. Los resultados fueron
publicados en
PNAS.
Complejidad del sistema
Las rutas bioquímicas pueden ser representadas como una
red de libre escala. Esto quiere decir que cada proteína (nodo) interactúa con otra (conexión). Sin embargo, hay proteínas que interactúan con muchas otras a la vez (un nodo con muchas conexiones), así como también hay muchas proteínas que interactúan con una sola (muchas conexiones que llegan a un solo nodo). Debido a esto, las redes bioquímicas están al borde del caos, digamos que en un estado dinámico metaestable, donde una pequeña perturbación en el sistema —por ejemplo, la mutación de una proteína— podría desencadenar la transición hacia otro estado diferente (proliferación descontrolada) o hacia el colapso del sistema (inactivación de protectores celulares).
Tuszynski y su equipo
estudiaron las redes bioquímicas de 14 tipos de cáncer obtenida de la Enciclopedia de Genes y Genomas de la Universidad de Kioto (
KEGG) y le calcularon el grado de entropía, una medida que representa la complejidad y heterogeneidad de la red (una red será más compleja cuanto más nodos y conexiones tiene). Además, colectaron las estadísticas de la probabilidad de supervivencia a 5 años de pacientes con cualquiera de los 14 tipos de cáncer descritos en KEGG obtenidos de la
base de datos del National Cancer Institute.
Al comparar ambos datos, los investigadores encontraron una clara correlación inversa entre el grado de entropía de la red bioquímica del cáncer con la probabilidad de supervivencia a 5 años. En otras palabras, los pacientes tenían menores probabilidades de sobrevivir si las redes bioquímicas y metabólicas eran más complejas.
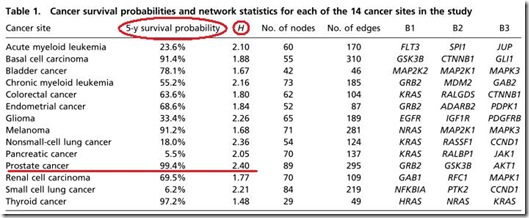
Tabla que muestra la probabilidad de supervivencia a 5 años, el grado de complejidad del cáncer, el número de nodos y conexiones, y los tres principales componentes de la red bioquímica.
Aunque, como pueden ver en la tabla, hubo una excepción a la regla. El cáncer de próstata mostró el mayor grado de complejidad (2.40), no obstante fue el que mayor probabilidad de supervivencia tuvo (99.4%). Según los investigadores, esto se debe a que ese tipo de cáncer es el más diferenciado y localizado de todos, además presenta una tasa de crecimiento muy baja, no se vasculariza y es morfológicamente distinto, por lo tanto, presenta un comportamiento distinto a los demás tipos de cáncer.
Al excluir al cáncer de próstata del análisis, se obtuvo una correlación entre estos dos factores de R2=0.7, el cual es un valor alto a pesar que muchas de las rutas bioquímicas de los diferentes tipos de cáncer aún podrían estar incompletas.
Este estudio además ha permitido identificar las proteínas claves en cada ruta bioquímica, los cuales podrían ser blancos para el desarrollo de nuevos agentes terapéuticos específicos para cada tipo de cáncer. Sin embargo, aún no podemos predecir lo que ocurrirá con el sistema si una de estas proteínas es inactivada. El desarrollo de nuevos modelos computacionales, sin dudas, ayudará a agilizar este proceso.
Referencia:
 Breitkreutz, D., Hlatky, L., Rietman, E., & Tuszynski, J. (2012). Molecular signaling network complexity is correlated with cancer patient survivability Proceedings of the National Academy of Sciences DOI: 10.1073/pnas.1201416109
Breitkreutz, D., Hlatky, L., Rietman, E., & Tuszynski, J. (2012). Molecular signaling network complexity is correlated with cancer patient survivability Proceedings of the National Academy of Sciences DOI: 10.1073/pnas.1201416109