Investigadores españoles han identificado una zona en una chaperona que le permite unirse a diversas proteínas y cambiar con ello su forma y su función.
Según se van sintetizando las proteínas en los ribosomas, éstas tienen que ir tomando la forma adecuada para poder ejercer su función. Aunque las características físico-químicas de los aminoácidos que las forman determinan en gran parte la forma que adquieren, hay muchas proteínas que necesitan ayuda extra de parte de un grupo de proteínas conocidas como chaperonas.
Para comprender mejor cómo funcionan estas proteínas, en su laboratorio del Centro Nacional de Biotecnología del CSIC (CNB), el grupo dirigido por José María Valpuesta ha utilizado la microscopía electrónica. Gracias a esta técnica han podido determinar por primera vez la estructura de un complejo formado por la chaperona DnaJ y su sustrato, lo que les ha permitido observar cómo la chaperona cambia la estructura del sustrato y con ello su función.
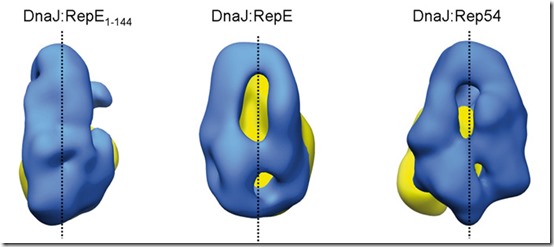
En colaboración con la Universidad del País Vasco, el investigador postdoctoral del CNB Jorge Cuéllar ha identificado además en dicha chaperona una zona de gran flexibilidad que le permite adaptarse a la forma de distintas proteínas. Como se puede apreciar en la imagen de portada, la forma que adopta la chaperona DnaJ (en azul) cambia radicalmente en función del sustrato al que se une (RepE1-144, RepE o Rep54; en amarillo). De este modo, una misma chaperona es capaz de unirse a una variedad de proteínas diferentes, consiguiendo en todas ellas que adquieran la forma necesaria para funcionar.
Referencia:
Cuéllar J, Perales-Calvo J, Muga A,Valpuesta JM, Moro F. Structural insights into the chaperone activity of the 40 kDa heat shock protein DnaJ. Binding and remodeling of a native substrate. J Biol Chem 2013 Apr 11. [doi: 10.1074/jbc.M112.430595].
Cortesía del CNB CSIC.





0 comentarios:
Publicar un comentario
Se respetuoso con tus comentarios y críticas. Cualquier comentario ofensivo será eliminado.