Los citómetros de flujo han sido una herramienta fundamental en el descubrimiento y caracterización de los diferentes tipos de células que conforman el sistema inmune. Esta técnica es tan poderosa que permite analizar más 10 parámetros simultáneamente, gracias al uso de anticuerpos marcados con moléculas fluorescentes. Sin embargo, la citometría de flujo parece haber llegado a su límite tecnológico, ya que cuando se pretende analizar más de 10 parámetros a la vez, la superposición de los espectros luminosos dificulta el análisis de los datos. Un grupo de investigadores norteamericanos y canadienses han mejorado la técnica gracias al uso de los principios de la espectrometría de masas según reportaron ayer en Science.
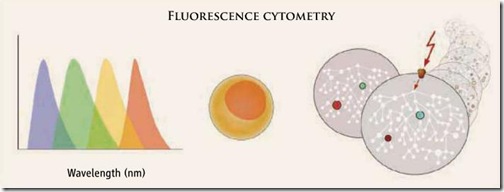
De manera sencilla, la citometría de flujo consiste en el paso de una suspensión celular a través de un láser. Para que las células puedan ser detectadas y diferenciadas unas de otras, son marcadas con moléculas fluorescentes que se excitan cuando el rayo láser incide sobre ellas, emitiendo fluorescencia de diferentes colores según el tipo de fluoróforo usado. Para que cada fluoróforo evidencie la presencia de un tipo celular diferente, éstos son conjugados con anticuerpos monoclonales que reconocen receptores o antígenos específicos en la superficie celular.
Por ejemplo. Las células B —también conocidos como linfocitos B— son unas células sanguíneas encargadas de producir los anticuerpos. Estas células se caracterizan por tener un antígeno específico en su membrana celular llamado CD20 (ninguna otra célula tiene este mismo antígeno), convirtiéndose en un marcador específico. Entonces, podemos tomar una molécula fluorescente (por ej.: rojo) y conjugarla con un anticuerpo que reconozca este antígeno (anti-CD20, comercialmente conocido como Rituximab®), de esta manera, cuando pase a través del citómetro de flujo, cada vez que aparezca la fluorescencia roja en el equipo nos indicaría que estamos ante la presencia de una célula B. De esta manera podemos cuantificarla, medirla y hasta aislarla.
Bajo este principio, se pueden usar más de un marcador para estudiar más características de manera simultánea. Por ejemplo, en la hematopoyesis (formación de todas las células sanguíneas a partir de células madre presentes en la médula ósea), a medida que las células se van diferenciando en diferentes tipos celulares, van expresando diferentes receptores, antígenos y otras proteínas. Se pueden diseñar anticuerpos que reconozcan cada uno de ellos y marcarlos con fluoróforos de diferentes colores y seguir paso a paso todo su proceso de diferenciación.
Sin embargo, el problema radica en que el espectro luminoso de una molécula fluorescente puede superponerse con el espectro de otra [ver figura inferior], limitando enormemente el número de marcadores que podemos analizar en simultáneo. Por otro lado, le quita resolución al análisis cuando se usan moléculas con espectros en longitudes de onda cercanas (por ej.: rojo y naranja) y no permitiría hacer un estudio detallado de las vías de señalización que se dan al interior de la célula.
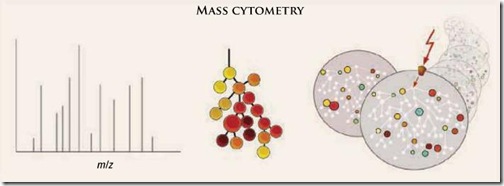
Fue así que el Dr. Sean C. Bendall y sus colaboradores desarrollaron una ingeniosa solución a este problema. En vez de usar moléculas fluorescentes usaron elementos químicos pesados (metales de transición y lantánidos) para marcar los diferentes anticuerpos desarrollados hasta el momento a través de un agente quelante (molécula que captura metales). Como la principal diferencia entre cada uno de estos elementos es su masa atómica, los podemos discriminar en base a su peso. El único equipo que puede hacer este trabajo es el espectrómetro de masas con un analizador de tiempo de vuelo (TOF-MS).
Lo que hace un espectrómetro de masas es vaporizar la sustancia a analizar hasta ionizarla, para luego pasarla a una determinada velocidad a través de un campo magnético. Los iones, en función a su carga y su masa (m/z), tendrán diferentes tiempos de vuelo antes de llegar al detector, los cuales serán únicos y específicos. En vez de tener espectros como en el caso de la fluorescencia, tendremos picos en valores puntuales. Cuanto el pico sea más grande, mayor será la cantidad de iones que llegaron al detector.
A este nuevo equipo lo llamaron citómetro de masas (CyTOF). Si bien su tasa de detección (1,000 células/s) no es tan alta como del citómetro de flujo (20,000 células/s), la precisión que ofrece un espectrómetro de masas que suprime por completo la superposición de espectros hace que la técnica tenga mucho potencial. Por otro lado, se elimina por completo la presencia del ruido de fondo, ya que los elementos químicos usados para marcar los anticuerpos se encuentran ausentes en nuestras células.
En el presente estudio, Bendall et al. lograron analizar 34 marcadores de manera simultánea usando el CyTOF. El número de marcadores que se pueden analizar al mismo tiempo puede ser mucho mayor y sólo dependerá de la cantidad de anticuerpos específicos disponibles en el mercado, ya que también se podrán usar los isótopos de los elementos antes mencionados.
Esta técnica demostró ser extremadamente sensible y permite un mayor grado de discriminación en tipos celulares. Por ejemplo, antes se consideraban a los linfocitos T CD4+ vírgenes (aquellos que nunca han sido expuestos a un antígeno, “nuevos”) como una población homogénea de células, pero, el CyTOF logró dividirlas en más de 10 sub-tipos diferentes.
Sin embargo, quizá la principal desventaja es que al vaporizar las muestras estas ya no podrán recuperarse, a diferencia del citómetro de flujo que no es una técnica destructiva. Así que el CyTOF podría usarse para hacer un análisis inicial de amplio rango y, una vez se tenga identificado lo que se quiere analizar de manera específica, usar la citometría de flujo tradicional para no perder la muestra.
Lamentablemente, el desarrollo de anticuerpos no es algo sencillo y barato como lo es la síntesis de sondas de ADN, además, los anticuerpos requieren de condiciones fisicoquímicas específicas (Ej.: pH, temperatura) para poder ser más estables, eficientes y específicas, así como para mejorar la conjugación con el agente quelante o los elementos químicos.
Los potenciales de esta técnica son muchos. Imagínense poder develar todos las reacciones que se dan en una determinada vía metabólica, tendríamos la capacidad de modificarla y aprovecharla. Podríamos determinar como responden las células ante distintas condiciones fisiológicas, podríamos analizar las distintas vías de señalización que se dan en el interior de las células responsables de activar determinados genes o bloquear otros.
El CyTOF permitirá el desarrollo del campo emergente de la “biología celular individual” permitiendo entender las intrincadas redes intracelulares. Por ahora, los estudios se hacen a nivel de poblaciones celulares, donde todo lo que sabemos se basa en un “comportamiento promedio” de todas las células que conforman un determinado órgano, tejido o cultivo celular. El CyTOF podría ayudarnos a entender como se da el desarrollo embrionario, donde todo un organismo complejo se inicia a partir de una única célula, que a través de pequeños cambios en la expresión de sus genes, le permiten diferenciarse en docenas de tipos celulares diferentes.
Además, es fácil ver las implicancias que podría tener esta técnica en el estudio de ciertas enfermedades y el efecto que tienen los agentes terapéuticos en el tratamiento de otras.
Y para terminar, un paso importante que se puede dar ahora es la integración de los primeros avances en la biología celular individual con la genómica, transcriptómica, proteómica y todas las ‘ómicas’ para entender mejor el funcionamiento de las células, el desarrollo de las enfermedades, etc.
Referencias:
Bendall, S., Simonds, E., Qiu, P., Amir, E., Krutzik, P., Finck, R., Bruggner, R., Melamed, R., Trejo, A., Ornatsky, O., Balderas, R., Plevritis, S., Sachs, K., Pe'er, D., Tanner, S., & Nolan, G. (2011). Single-Cell Mass Cytometry of Differential Immune and Drug Responses Across a Human Hematopoietic Continuum Science, 332 (6030), 687-696 DOI: 10.1126/science.1198704
Benoist, C., & Hacohen, N. (2011). Flow Cytometry, Amped Up Science, 332 (6030), 677-678 DOI: 10.1126/science.1206351






0 comentarios:
Publicar un comentario
Se respetuoso con tus comentarios y críticas. Cualquier comentario ofensivo será eliminado.