Se expresa en la superficie de todos los tumores sólidos humanos y su bloqueo promueve la acción de los macrófagos.
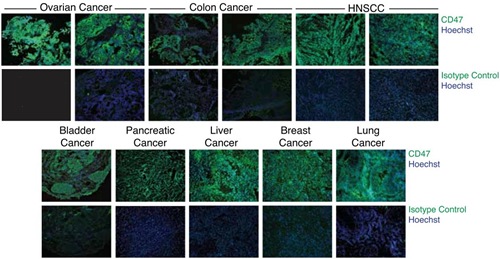
| Comparación de la expresión de CD47 (verde) entre tejidos cancerosos y tejidos sanos. |
Los tumores han desarrollado muchas estrategias que les permiten sobrevivir y diseminarse por el cuerpo. Una de ellas es evitar ser devorados por los macrófagos (fagocitosis), unas células del sistema inmune que se encarga de eliminar cualquier agente extraño o perjudicial para nuestro organismo. Para esto expresan un antígeno de superficie llamado CD47, que se une a una proteína señalizadora en los macrófagos llamada SIRPα, encargada de inhibir la fagocitosis. En otras palabras, la CD47 actúa como una señal de “no me comas”.
Usando proteínas fluorescentes verdes asociadas al CD47, un grupo de investigadores liderados por el biólogo Irving Weissman del Instituto Ludwig de Investigación del Cáncer, descubrieron que esta señal estaba presente en casi todos los tipos de cáncer estudiados: ovarios, seno, colon, páncreas, hígado, vejiga, pulmones y escamoso de cabeza y cuello; todos caracterizados por presentar tumores sólidos.
Además, al analizar los niveles de expresión de CD47 en individuos con leucemia mieloide y linfomas, Weissman y su equipo encontraron una fuerte correlación entre la cantidad de ARN mensajero de este antígeno y la baja esperanza de vida del paciente, lo que indicaría que podría ser usado como un factor de pronóstico clínicamente relevante en ciertos tipos de tumores sólidos.
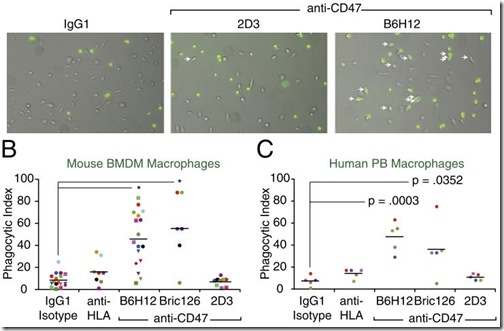
En vista que CD47 es esencial para la supervivencia de los tumores, los investigadores se preguntaron ¿qué pasaría si este antígeno es bloqueado? Para responder esta interrogante, Weissman y sus colaboradores desarrollaron anticuerpos monoclonales contra CD47 (anti-CD47) y probaron su efecto en diferentes tipos de cáncer. Lo que observaron fue sorprendente, tal como predijeron, los tumores cultivados en el laboratorio y tratados con anti-CD47 fueron atacados y fagocitados por los macrófagos, tanto humanos como de ratones. Los resultados fueron publicados el 26 de Marzo en PNAS.
Como los resultados in vitro fueron muy alentadores, el siguiente paso era saber si lo mismo ocurría en un animal vivo. Como el tratamiento con anti-CD47 funcionó tanto con macrófagos humanos como de ratones, Weissman y su equipo tomaron diferentes tumores humanos y los insertaron en ratones con el sistema inmunológico suprimido (para evitar el rechazo del injerto), un proceso conocido como xenotrasplante de tumores.
Cuando los ratones fueron tratados con el anti-CD47, los tumores se redujeron considerablemente, algunos desaparecieron y ninguno llegó a diseminarse a otros tejidos del cuerpo (metástasis). Y no sólo eso, los ratones que recibieron el tratamiento incrementaron dramáticamente su esperanza de vida. Los ratones que recibieron un xenotrasplante de cáncer de mama, por ejemplo, no desarrollaron el tumor incluso cuatro meses después de haber dejado de recibir el tratamiento.
Sin embargo, debemos recordar que los experimentos in vivo han sido realizados en ratones. El ambiente que rodea a los tumores xenotrasplantados es diferente al que rodea a los tumores presentes en los humanos, el cual es mucho más protector. Esto podría jugar un rol importante a la hora de estudiar la eficacia del tratamiento en personas.
No obstante, el funcionamiento básico del anti-CD47 ha sido demostrado en macrófagos humanos, y esto da muchas esperanzas. Este anticuerpo demostró no solo reducir el tamaño de los tumores, incluso desaparecerlos, sino también inhibir la metástasis, un proceso responsable de la ineficacia de los tratamientos actuales.
El antígeno CD47 se expresa en casi todos los tumores sólidos humanos. Un tratamiento basado en un anticuerpo que bloquee su función antifagocitaria sería de gran utilidad para la medicina porque podríamos tratar muchos tipos de cáncer con un único agente terapéutico. De todas maneras, debemos tener bien puestos los pies sobre la tierra, muchas veces las cosas funcionan muy bien in vitro y en animales de laboratorio, pero cuando se analiza en humanos ya no tiene la misma eficiencia o presenta efectos secundarios indeseados que terminan por desbaratar todo lo avanzado.
Ahora, Weissman y su equipo recibieron un financiamiento de 20 millones de dólares para llevar sus experimentos a humanos y empezar con los primeros ensayos clínicos.Tengo la confianza que la terapia basada en el anti-CD47 será efectiva, al menos, en unos cuantos tipos de tumores.
Referencia:
Willingham, S., Volkmer, J., Gentles, A., Sahoo, D., Dalerba, P., Mitra, S., Wang, J., Contreras-Trujillo, H., Martin, R., Cohen, J., Lovelace, P., Scheeren, F., Chao, M., Weiskopf, K., Tang, C., Volkmer, A., Naik, T., Storm, T., Mosley, A., Edris, B., Schmid, S., Sun, C., Chua, M., Murillo, O., Rajendran, P., Cha, A., Chin, R., Kim, D., Adorno, M., Raveh, T., Tseng, D., Jaiswal, S., Enger, P., Steinberg, G., Li, G., So, S., Majeti, R., Harsh, G., van de Rijn, M., Teng, N., Sunwoo, J., Alizadeh, A., Clarke, M., & Weissman, I. (2012). The CD47-signal regulatory protein alpha (SIRPa) interaction is a therapeutic target for human solid tumors Proceedings of the National Academy of Sciences DOI: 10.1073/pnas.1121623109






Seria probable en gliomas de tronco cerebral?es qque a mi hijito de tres años le detectaron hace tres meses y estamos desesperados alebravo_9@hotmail.com muchisima suerte que dios los acompañe asi paremos de sufrir
ResponderBorrar