Las enzimas son la base del metabolismo celular, gracias a ellas las células pueden generar la energía necesaria para vivir, producir los bloques de construcción de sus membranas y organelos, duplicar su material genético cada vez que se dividen, sintetizar hormonas y otras moléculas señalizadoras, degradar las toxinas, y hacer muchas cosas más. En otras palabras, las enzimas son unas macromoléculas capaces de llevar a cabo una serie de reacciones químicas que de manera natural no se podrían realizar o necesitarían una gran cantidad de energía para hacerlo.
Para serles sincero, hasta ahora yo creía que las enzimas llevaban a cabo muchas reacciones antes de degradarse, siendo su reusabilidad una de sus principales características. En un artículo publicado esta semana en Nature, un grupo de investigadores norteamericanos han descrito el mecanismo de acción de una de las enzimas que participan en la síntesis de la vitamina B1 (Tiamina Pirofosfato), descubriendo que ésta sólo realiza una única reacción para después quedar inutilizable. En otras palabras, se trata de una enzima suicida.
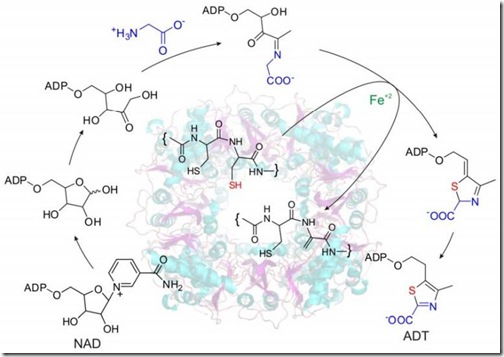
La vitamina B1 es un cofactor esencial en todos los seres vivos. Para su síntesis se requiere de dos precursores: una pirimidina y un tiazol azufrado. El mecanismo de síntesis de la pirimidina está muy bien entendido; sin embargo, la gran interrogante que queda es de dónde proviene el azufre del tiazol.
Cuando aislaron y estudiaron los intermediarios que participan en la síntesis del tiazol, los científicos observaron que una enzima era purificada conjuntamente con tres de ellos. Esta enzima es conocida como la THI4p (tiamina tiazol sintasa). Cuando la analizaron bajo el espectrómetro de masas se dieron con la sorpresa que su peso era de 34 Daltons (Da) menor a lo predicho a partir de la secuencia genética que la codifica. Sin embargo, cuando la enzima no era funcional debido a una mutación, ya no se observaba estos 34Da de déficit. Esto indicaba que esta modificación era clave en el funcionamiento de la enzima.
Para analizar con mayor profundidad el sitio activo, Chatterjee y sus colaboradores partieron la enzima en muchos pedacitos con la ayuda de una quimiotripsina —un tipo de proteasa que rompe los enlaces peptídicos de las proteínas. Cuando estudiaron la porción de la proteína que contenía al sitio activo vieron que habían dos cisteínas (CyS) juntas en las posiciones 204 y 205. Las cisteínas son aminoácidos que se caracterizan por tener el grupo “tiol” (R-SH), que junto con la metionina, son los dos únicos aminoácidos azufrados.
Con estas dos pistas —las cisteínas adyacentes y el déficit de 34Da— los investigadores sospechaban que el azufre del tiazol provenía de una de estas dos cisteínas. Por si no se dieron cuenta, el azufre pesa 32Da y el hidrógeno 1Da, entonces el grupo SH2 que pasa al tiazol pesa 34Da, justo los que se pierden de la enzima. Esto lo confirmaron cuando al sitio activo le hicieron un tratamiento con a una acetamida (un compuesto que se une a los residuos -SH de la cisteína). Cuando la enzima estaba mutada, la acetamida (CM) se unía a las dos cisteínas, algo que no ocurría cuando la enzima era funcional.
 Fragmento correspondiente al sitio activo. CC corresponde a las cisteínas. WT es la versión normal o silvestre y R301Q es la versión mutada. Las acetamidas (CM) sólo pueden unirse a la versión mutada porque el azufre de la cisteína-205 no puede pasar al tiazol. Cuando el azufre de la Cys-205 se pierde, se forma una dehidroalanina, la cual reacciona con el azufre del Cys-204 formando un enlace cíclico que no puede reaccionar con la acetamida. Fragmento correspondiente al sitio activo. CC corresponde a las cisteínas. WT es la versión normal o silvestre y R301Q es la versión mutada. Las acetamidas (CM) sólo pueden unirse a la versión mutada porque el azufre de la cisteína-205 no puede pasar al tiazol. Cuando el azufre de la Cys-205 se pierde, se forma una dehidroalanina, la cual reacciona con el azufre del Cys-204 formando un enlace cíclico que no puede reaccionar con la acetamida. |
Para saber cuál de los dos azufres era el que pasaba al tiazol, los investigadores mutaron y remplazaron las cisteínas por serinas. Los resultados mostraron que sólo el cambio de la Cys-205 por la serina provocaba una pérdida de la función enzimática. Esto indicaba que era la Cys-205 la que donaba su grupo SH2 al tiazol. Una vez que la cisteína-205 perdía su azufre, se convertía en una dehidroalanina formando un enlace cíclico con el grupo –SH de la cisteína-204, evitando su unión a la acetamida.
Chatterjee et al. también descubrieron que la THI4p era dependiente de el Hierro (II) (Fe2+). Cuando las bacterias que portaban este gen los pusieron en un medio mínimo (M9), la síntesis de vitamina B1 se reducía considerablemente. La función se restauraba una vez que se agregaba el hierro (II) al medio. Los investigadores determinaron que el hierro (II) activa el grupo tiol y se da en condiciones anaeróbicas porque se oxida con gran facilidad formando FeO (óxido ferroso).
Finalmente, Chatterjee y sus colegas observaron que la enzima THIp4 no se regeneraba y no se podía volver a usar una vez que perdía su azufre. Todas las enzimas que participan en la biosíntesis de la vitamina B1 se expresan en cantidades muy bajas; sin embargo, la THIp4 está sobreexpresada. Cuando analizaron las proporciones de THI4p y vitamina B1, estas eran iguales (1:1) —cada enzima producía un tiazol.
Este caso, si bien es bastante inusual, no es el primero. En el año 1985 Demple et al. descubrieron a la primera enzima suicida. Se trataba de la proteína Ada, una metiltransferasa que repara las O6-metilguaninas y los metilfosfotriésteres del ADN cuando sufren algún tipo lesión. Como su nombre lo dice, repara el daño transfiriendo el grupo metil de una cisteína de su sitio activo. En este caso, la enzima inactiva que queda funciona como un inductor de su propio gen, generando más proteínas Ada que reparan más lesiones.
Sin embargo, queda por investigar si la THIp4 inactiva también tiene un efecto inductor similar a la proteína Ada. Lo cierto es que hay casos en que las enzimas pueden funcionar tan sólo una vez, contradiciendo nuestra creencia de que todas las enzimas pueden reusarse muchas veces antes de degradarse.
Referencia:
Chatterjee, A., Abeydeera, N., Bale, S., Pai, P., Dorrestein, P., Russell, D., Ealick, S., & Begley, T. (2011). Saccharomyces cerevisiae THI4p is a suicide thiamine thiazole synthase Nature, 478 (7370), 542-546 DOI: 10.1038/nature10503
Esta entrada participa en la VIII Edición del Carnaval de Química celebrado en el excelente blog Caja de Ciencia.






0 comentarios:
Publicar un comentario
Se respetuoso con tus comentarios y críticas. Cualquier comentario ofensivo será eliminado.