Mañana (1ro de Diciembre) se celebra el Día Mundial del SIDA, así que haremos una breve explicación de la latencia del VIH en los linfocitos-T CD4+
El ciclo del vida del Virus de Inmunodeficiencia Humana (VIH) es bastante similar al de otros virus. Una vez que una persona es contagiada, las partículas virales reconocen a los linfocitos-T CD4+ y los invaden. Debido a que su material genético está hecho de ARN, este debe ser transformado a ADN —mediante una transcriptasa inversa— para poder integrarse al genoma de la célula hospedera. En este punto al virus se le conoce como un provirus.
El provirus aprovecha de las enzimas y factores de transcripción de la célula que ha infectado para hacer muchas copias de sí mismo y producir nuevas partículas virales que serán liberadas para infectar otras células sanas. Este paso está controlado por la región LTR (repetición terminal larga).
Las terapias a base de anti-retrovirales lo que hacen es inhibir la replicación del virus a este nivel. Sin embargo, un pequeño porcentaje de los provirus no se activan y se mantienen latentes en el genoma de los linfocitos-T durante muchos años, hasta que las condiciones sean las adecuadas, por ejemplo: cuando el tratamiento es suspendido o cuando el sistema inmune responde ante una infección. Si bien los anti-retrovirales mantienen los niveles de VIH por debajo de los límites de detección, la insensibilidad de los virus latentes al tratamiento hace imposible su erradicación. En el momento menos pensado, los virus latentes pueden reactivarse provocando una viremia mortal o el desarrollo del SIDA.
Pero, ¿de qué factores depende que el virus esté activo o latente?. En un artículo publicado en PLoS Biology, investigadores del Centro Médico de la Universidad de Erasmus (Holanda) y de la UC San Francisco (EEUU), liderados por la Dra. Haleh Rafati, han revelado las claves moleculares de la latencia y la activación del VIH.

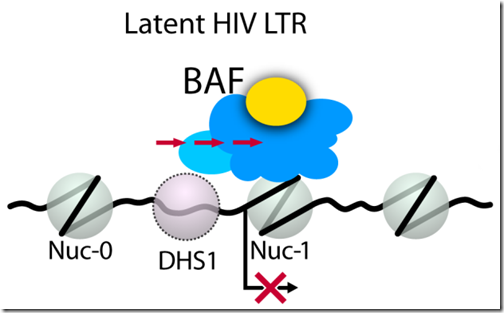
Estudios previos demostraron la presencia de tres nucleosomas en la región 5’ de LTR: nuc-0, nuc-1 y nuc-2; separados por dos fragmentos de ADN libre: DHS1 y DHS2. De los tres nucleosomas, nuc-1 está ubicado justo después de la región promotora de LTR (lugar donde los factores de transcripción de la célula se unen al ADN para promover la expresión de los genes virales). Sin embargo, los nucleosomas también pueden ser modificados para liberar la región promotora y se cree que esta es la clave de la latencia del VIH.
Existen diferentes clases de complejos enzimáticos que usan la energía obtenida de la hidrólisis del ATP para modificar las histonas y remodelar la cromatina. La clase SWI/SNF es uno de ellos. Estudios previos realizados por otros laboratorios encontraron datos contradictorios con respecto al papel que cumple SWI/SNF en la activación y latencia del VIH: algunos demostraban que SWI/SNF promovían la expresión viral, mientras que otros que la reprimían. El problema radicaba en que las células de los mamíferos presentan dos formas de SWI/SNF llamadas BAF y PBAF:
Para determinar la función que cumplen tanto BAF como PBAF, Rafati y sus colaboradores usaron líneas celulares humanas infectadas con el VIH. Lo primero que descubrieron fue que BAF se unía a la región nuc-1, desplazando al nucleosoma que está presente en DHS1, y reprimiendo la expresión de LTR, proceso clave en la latencia del virus. Sin embargo, cuando insertaron un ARN de interferencia (ARNi) para bloquear la expresión de la subunidad BAF250a (específica de BAF), los investigadores observaron que LTR volvía a expresarse y el provirus se activaba.
No ocurría lo mismo cuando se inactivaba PBAF a través del bloqueo de la subunidad BAF180 con otro ARNi. Este primer resultado demostraba que BAF es importante en la latencia del virus porque se une a la región promotora de LTR, evitando que los factores de transcripción hagan su trabajo.
Cuando las condiciones son favorables para la replicación y diseminación del virus, BAF se libera de nuc-1. El nucleosoma vuelve a regenerarse y es acetilado gracias a la presencia de la proteína transactivadora Tat que es la encargada de reclutar a las p300 (una enzima acetil transferasa). Una vez acetilado, PBAF se une a ellos y promueve la expresión de LTR.
Si bien hay muchas interrogantes por responder, por ejemplo: ¿de qué depende la unión de BAF a nuc-1 para inactivar la expresión del virus? ¿las concentraciones basales de BAF y PABF en las células rigen el destino del virus? ¿cómo se activa Tat cuando el provirus está reprimido?; estos resultados muestran la importancia de los complejos BAF y PBAF en el ciclo de vida del VIH. Rafati et al. demostraron que el bloqueo de BAF reduce la habilidad del VIH de entrar en la fase de latencia, el cual puede servir como punto de partida para el desarrollo de agentes terapéuticos que actúen sobre BAF para que el virus siga replicándose y sea sensible a los tratamientos anti-retrovirales.
Referencia:
Haleh Rafati, Maribel Parra, Shweta Hakre, Yuri Moshkin, Eric Verdin, & Tokameh Mahmoudi (2011). Repressive LTR Nucleosome Positioning by the BAF Complex Is Required for HIV Latency PLoS Biology DOI: 10.1371/journal.pbio.1001206







0 comentarios:
Publicar un comentario
Se respetuoso con tus comentarios y críticas. Cualquier comentario ofensivo será eliminado.