La microscopía es una de las herramientas más importantes de la biología celular y molecular, ya que nos ha permitido revelar las estructuras y formas subcelulares, como el núcleo, las mitocondrias y las membranas citoplasmáticas. Durante los últimos años, la microscopía ha avanzado mucho, permitiéndonos no sólo observar imágenes estáticas, sino también, ver estructuras complejas en pleno movimiento, y así entender mejor la dinámica celular.
La microscopía electrónica (ME) nos ha permitido ver estructuras tan pequeñas como los virus. La ME de barrido, nos ha permitido ver de manera nítida y con gran resolución la superficie de células, bacterias, membranas, dándonos una imagen tridimensional de las mismas. Sin embargo, uno de los más grandes avances en la microscopía fue el desarrollo de la criomicroscopía electrónica (cryo-EM), la cual – usando temperaturas extremadamente bajas – permiten ver, de manera directa, la forma de pequeñas estructuras como los ribosomas y hasta ciertas proteínas y enzimas. A partir de esta técnica se desarrolló la tomografía crioelectrónica, que toma imágenes de la muestra, desde distintos ángulos, para resolver la estructura tridimensional final. Esto combinado con la cristalografía de rayos X han sido muy útiles para el desarrollo de la biología estructural.
Imagen ©MIT
Sin embargo, para usar estas técnicas se debe purificar la estructura que queremos observar, y las imágenes son estáticas, no podemos usar la ME in vivo. Fue así que se desarrollaron técnicas de marcación de moléculas con tintes, y posteriormente, con moléculas fluorescentes. Usando estas técnicas se pudo, por ejemplo, determinar la dinámica de la división celular, marcando con una molécula fluorescente el ADN y con otro los microtúbulos, y ver en vivo y en directo, como es su dinámica durante cada una de las fases de la división celular.
Imagen ©2009 Biochemical Society. Xu, T; et al. doi: 10.1042/BJ20082020
Pero, muchos de los tintes y moléculas fluorescentes son tóxicas para los organismos vivos, además, pueden perturbar el funcionamiento mismo de las células, o sea, no es lo mismo la migración de los cromosomas en la anafase con una molécula accesoria (la fluorescente) que sin ella.
Así que, en los últimos años, empezaron a desarrollarse las imágenes de resonancia magnética (MRI) a nivel celular, las cuales se caracterizaban por una gran penetración en las estructuras celulares pero carecían de una buena resolución. Fue así que aparecieron otras técnicas de imagen ópticas complementarias a las MRI, las cuales tenían un mayor poder de resolución espacio-temporal.
Estas nuevas técnicas de imágenes ópticas se valen de la frecuencia de las vibraciones de los enlaces de las distintas especies químicas (grupos funcionales) que conforman una determinada biomolécula. Unas de ellas se basa en la espectroscopía Raman, la cual mide la dispersión de un fotón que choca contra un determinado enlace químico. Cada tipo de enlace desviará el fotón de diferente manera. De esta manera se obtendrán imágenes a partir de las vibraciones. Cada biomolécula tiene enlaces diferentes, y podemos usar estas técnicas para diferenciar una especie química de otra y así observar sólo un tipo de biomolécula.
La primera técnica basada en este principio fue CARS (Dispersión Raman Coherente Anti-Stokes), la cual usa tres rayos con diferentes frecuencias, las cuales interactúan con la muestra generando una señal óptica coherente que permite visualizar estructuras biológicas, sin embargo presenta algunos inconvenientes: sufre de una distorsión espectral que no permite diferenciar fácilmente las vibraciones de la muestra de la del fondo, limitando su sensibilidad, y no tiene una dependencia linear con la concentración de las moléculas de la muestra.
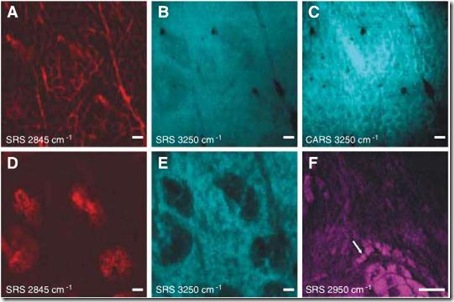
Pero, Saar et al. de la Universidad de Harvard han desarrollado una técnica que permite superar las limitaciones que tiene CARS mediante el uso de la Dispersión Estimulada de Raman (SRS) que permite un mayor contraste vibracional entre la muestra y el fondo; además, ha permitido capturar las imágenes de manera mucho más rápida, pero no lo suficiente como para usarlo en animales y humanos, ya que no generar distorsiones deberíamos permanecer estáticos por los menos un minuto, y a nivel microscópico es imposible. La velocidad de captura es de unos 25 cuadros por segundo a una resolución de 525x525 pixeles, lo cual permite hacer videos del movimiento de las moléculas en vivo.
Aquí algunas imágenes obtenidas con esta técnica:
A) Lípidos en la capa córnea, donde se muestran los corneocitos hexagonales. B) Moléculas de agua en la misma región usando SRS. C) Moléculas de agua en la misma región usando CARS, se puede apreciar la interferencia con los lípidos mostrados en A. D) Lípidos en la epidermis de las glándulas sebáceas. E) Moléculas de agua en la misma región. F) La misma región pero usando la vibración del CH3 para apreciar las proteínas y las estructuras residuales ricas en lípidos.
Aquí les pongo el espectro Raman de varios compuestos químicos, para que lo puedan relacionar con la imagen anterior en base a la longitud de onda de las vibraciones de los enlaces químicos.
Para descargar y ver los asombrosos videos tomados usando esta técnica visitar: http://bit.ly/gdXMXi
Referencia:
Saar, B., Freudiger, C., Reichman, J., Stanley, C., Holtom, G., & Xie, X. (2010). Video-Rate Molecular Imaging in Vivo with Stimulated Raman Scattering Science, 330 (6009), 1368-1370 DOI: 10.1126/science.1197236









0 comentarios:
Publicar un comentario
Se respetuoso con tus comentarios y críticas. Cualquier comentario ofensivo será eliminado.