Las células epiteliales normales juegan un papel muy importante en el mantenimiento de la homeostasis a través de la secreción de factores autocrinos —que actúan sobre la misma célula— y paracrinos —que se diseminan a otros tejidos a través de la sangre. Estos factores regulan la expresión de determinados genes que mantienen a las células saludables; pero, cuando se detecta una célula con un crecimiento aberrante (cancerosa), dichos factores pueden activar los mecanismos de muerte celular programada (apoptosis) para evitar que lleguen a ser perjudiciales. Uno de ellos —la Interleucina-25 (IL-25)— es liberado por las células mamarias sanas y tienen la capacidad de inducir la apoptosis en células mamarias cancerosas según un reporte que apareció el día de ayer en Science Translational Medicine.
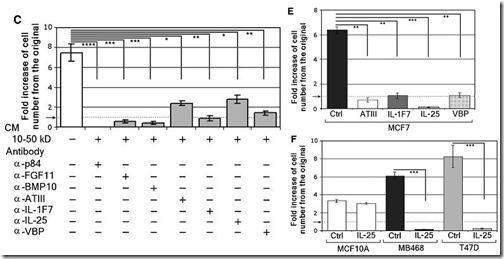
Para identificar los componentes secretados por las células sanas con un posible efecto citotóxico sobre las células malignas, Furuta et al. cultivaron células mamarias epiteliales normales junto a una línea de células mamarias cancerosas (MCF7), purificando y separando todos los componentes secretados al medio de cultivo. Las moléculas obtenidas, que tenían un tamaño que variaba entre 10 y 50kDa, fueron sometidas a un análisis por Cromatografía Líquida y Espectrometría de Masas (HPLC-MS). A través de un estudio comparativo se lograron identificar seis factores distintos.
De los seis factores identificados en el experimento anterior, cuatro de ellos estaban relacionados directamente con el efecto citotóxico de las células sanas sobre las células cancerosas. Luego, usaron líneas celulares sanas modificadas genéticamente para que sobre-expresen cada uno de los cuatro factores seleccionados, para ver cual de ellos era el que tenía el mayor efecto citotóxico. Furuta y sus colaboradores descubrieron que era la Interleucina-25 (IL25, también conocida como IL-1F7) el que tenía un efecto más potente, no sólo en la línea celular MCF7, sino también, en otras dos líneas celulares mamarias cancerosas (T47D y MDA-MB468).
[Click para agrandar los gráficos]
Tanto en humanos como en ratones, el gen que codifica para la IL-25 tiene los mismos elementos regulatorios, facilitando enormemente el análisis fisiológico comparativo entre el modelo biológico (el ratón de laboratorio) y los humanos. En cuanto a la expresión de este factor en las glándulas mamarias, los ratones mostraron que los niveles de IL-25 aumentaban gradualmente a partir de la pubertad hasta la mitad del periodo de gestación.
Luego, los investigadores aislaron y purificaron la IL-25 para determinar la concentración a la que tiene el mejor efecto citotóxico sobre las células mamarias cancerosas. Probaron diferentes dosis de IL-25 sobre diferentes líneas celulares cancerosas, encontrando que la concentración media inhibitoria (IC50) fue de 10ng/ml (500pM). Además, observaron que la línea celular no-maligna (células normales) eran relativamente resistentes a la IL-25, lo que indicaría que si se aplica como un agente terapéutico para una quimioterapia, las células sanas no correrían el riesgo de ser afectadas.
Así que, una vez determinada la IC50, los investigadores procedieron a estudiar su capacidad para combatir tumores. Para ello usaron una línea celular del cáncer de mama llamada MDA-MB468 y lo dejaron crecer por 10 días hasta formar un tumor. Luego, se insertó este tumor en depósitos de grasa mamarias de ratones a los cuales les dieron dosis de 300ng por día, durante un mes. El tamaño del tumor fue analizado dos veces por semana y se observó que éste se redujo tres veces más que en el control (el cual recibía búfer fosfato en vez de IL-25). Por otro lado, no se observó una pérdida de peso ni tejidos dañados o inflamados en los ratones, lo que indica que las dosis de IL-25 no fueron tóxicas para los animales, así se les haya inyectado 5 veces la dosis máxima (1.5ug).
A través de un análisis de la expresión genética, los investigadores observaron que en las células mamarias cancerosas expresaban una mayor cantidad del receptor IL-25R, el cual estaba directamente relacionado con la habilidad para crecer de los tumores. Cuando se silenciaba el ARNm IL-25R, la capacidad proliferativa de los tumores se reducía considerablemente. Es debido a este receptor que las células cancerosas son tan sensibles a la presencia de la IL-25, mientras que las células normales, al no expresar dicho receptor, son insensibles.
Cuando la IL-25 se une al receptor IL-25R, ocurre una cascada de reacciones de señalización que activan los factores involucrados en la apoptosis. Al analizar las biopsias de muestras de pacientes con cáncer de mama, aproximadamente el 20% de todas las células mamarias cancerosas tienen activo este receptor. Con todos estos datos se propuso el siguiente modelo de acción de la IL-25:
Ahora Furuta y sus colaboradores están analizando los otros 5 factores aislados en este experimento para ver si el efecto de la IL-25 puede ser potenciado sinérgicamente con uno de ellos, para así desarrollar un tratamiento efectivo contra el cáncer de mama, que no afecte las células, uno de los principales problemas involucrados con la quimio y radioterapia.
Referencia:
Furuta, S., Jeng, Y., Zhou, L., Huang, L., Kuhn, I., Bissell, M., & Lee, W. (2011). IL-25 Causes Apoptosis of IL-25R-Expressing Breast Cancer Cells Without Toxicity to Nonmalignant Cells Science Translational Medicine, 3 (78), 78-78 DOI: 10.1126/scitranslmed.3001374







0 comentarios:
Publicar un comentario
Se respetuoso con tus comentarios y críticas. Cualquier comentario ofensivo será eliminado.