Uno de los principales inconvenientes que tenemos al momento de administrar un determinado fármaco a un paciente es que no toda la dosis llega al tejido que está enfermo. Existe un porcentaje que interactúa con las células sanas de otros tejidos —o del mismo tejido—, provocándoles un daño no deseado (efecto secundario). Este suceso ocurre generalmente porque el agente terapéutico no es completamente específico por el tejido dañado o, si se usa un transportador, este pierde su especificidad debido a las condiciones fisiológicas de nuestro organismo (Ej.: la acción del sistema inmune, las vesículas digestivas, la degradación por la temperatura, el pH, las enzimas, etc.)
Los efectos secundarios son muy frecuentes en la quimioterapia. Los compuestos anticancerígenos no son más que pequeñas moléculas que de alguna manera interactúan con las células, sean cancerosas o no, deteniendo su ciclo celular y provocándoles la muerte (citotoxicidad). Para evitar que las células sanas sean afectadas, por lo general, se usa una molécula transportadora a la cual se le conjuga el agente terapéutico. Esta molécula transportadora puede ser un compuesto afín por un determinado tejido (Ej.: el pirofosfato, afín por los huesos) o un ligando que se une a un receptor específico de la superficie de la membrana celular de la célula cancerosa (Ej.: el Anti-CD20, que se une al antígeno CD20 expresado en ciertos linfomas).
Este último tipo de transportadores (receptor-ligando) han sido los más usados durante los últimos años gracias a su altísima especificidad, baja toxicidad e inmunoreactividad (no producen intoxicaciones o respuestas inflamatorias), y son de fácil administración. Sin embargo, debido a que son biomoléculas, requieren de ciertas condiciones fisiológicas para mantener su estructura tridimensional, siendo muy sensibles a la presencia de otras moléculas dentro del organismo, el pH del suero sanguíneo o la temperatura corporal; las cuales crean una inestabilidad en el transportador, provocando la pérdida de su agente terapéutico, que tendrá la libertad para dirigirse hacia cualquier otro tejido sano.

Los liposomas se asemejan mucho a unas pequeñas células… mejor dicho, se parecen mucho a pequeñas células sin núcleo ni organelos, o sea, una pequeña vesícula con una bicapa lipídica. Dentro de estos liposomas podríamos poner cualquier agente terapéutico; y en la superficie de su membrana, podríamos insertarle pequeñas moléculas receptoras o ligandos específicos que reconozcan las proteínas de membrana de las células cancerosas.
Actualmente, estos nanotransportadores ya vienen siendo desarrollados en muchos laboratorios del mundo, pero aún no son lo suficientemente efectivos o estables como para pasar a los primeros ensayos clínicos. Si bien, en teoría, se ve bastante sencillo, no es lo mismo en la práctica.
Un gran avance lo dieron científicos de la Universidad de Nuevo México quienes han desarrollado unas nanopartículas lisosomales de 150nm de diámetro las cuales tienen una gran afinidad por células cancerosas hepáticas, y que han mejorado su capacidad de eliminarlas gracias a una combinación de diferentes fármacos según reportaron ayer en Nature Materials.
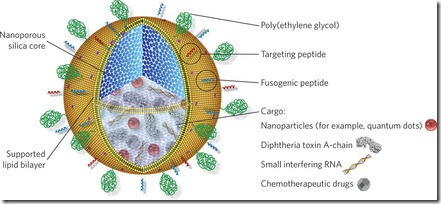
La gran innovación que tiene este nanotransportador es que dentro de los liposomas tienen una nanoestructura similar al de un panal de abejas hecho de sílice (nanoporos de sílice) donde los agentes terapéuticos son insertados (‘protocélula’). Estas nanocavidades permiten tener una mayor área superficial donde conjugar los fármacos; además, permite separarlos independientemente dentro de la protocélula. De esta manera, se le puede administrar al paciente un ‘coctel’ de fármacos que le permitirán mejorar la efectividad del tratamiento, sobre todo, en aquellos que tienen células cancerosas y tumores resistentes a los fármacos.

La FDA aprobó hace algún tiempo el uso de lisosomas artificiales para el transporte de determinados fármacos, así que no habrá inconvenientes en aprobar estas protocélulas transportadoras ya que la composición básica estructural es casi la misma (una bicapa lipídica). La única diferencia son los nanoporos de sílice de su interior, los cuales son inertes y no interactuarán con las biomoléculas de nuestro organismo generando algún tipo de respuesta inflamatoria.
Al comparar el efecto citotóxico de los nanotransportadores de liposomas y los de protocélulas, vieron que estos últimos tenían una eficacia superior en un millón de veces (106X) comparado con los liposomas. Esta eficacia se debe a que los nanotransportadores de protocélulas tienen una mayor estabilidad, una mayor capacidad de carga y una mayor especificidad.
Imagen izquierda: Protocélulas entrando y liberando su carga dentro del citoplasma y núcleo de una línea celular cancerosa hepática. Imagen derecha: Una célula normal (no-cancerosa) hepática no presenta una invasión de los nanotransportadores, ya que no tiene los receptores de membrana específicos de las células cancerosas.
Una de las ventajas de estos nanotransportadores es que pueden combinarse distintos agentes terapéuticos sin correr el riesgo que interactúen entre ellos. Esto quiere decir que podemos poner dentro de la misma protocélula agentes antitumorales (Ej.: Taxol®, Sorafenib®), ARN de interferencia (terapia génica) y hasta radioterapéuticos. El efecto conjunto de ellos podría mejorar enormemente el tratamiento de tumores y cánceres resistentes a fármacos.
Por otro lado, debido a que los agentes terapéuticos se encuentran contenidos dentro de la protocélula, pueden circular por nuestro organismo durante días y aún así ser inocuos.
Sin embargo, lo más difícil de esta tecnología es identificar los receptores específicos de membrana que sean exclusivos de las células cancerosas, para no generar una reacción cruzada con las células sanas. Identificar estas pequeñas moléculas, generalmente proteínas integrales de membrana, es difícil; más difícil aún es diseñar un ligando específico para esa proteína. Este ligando debe ser lo más sencillo posible (generalmente pequeños péptidos), pero sin dejar de ser específico.
Por ahora, estos nuevos nanotransportadores vienen siendo probados in vivo, y pronto pasarán a experimentarse en ratones con tumores inducidos. También se está optimizando la técnica para fabricar los nanoporos de sílice (en Brinker Lab) y la introducción de estos a los liposomas. Los investigadores creen que la tecnología estará disponible comercialmente dentro de unos cinco años.
Referencias:
Ashley, C., Carnes, E., Phillips, G., Padilla, D., Durfee, P., Brown, P., Hanna, T., Liu, J., Phillips, B., Carter, M., Carroll, N., Jiang, X., Dunphy, D., Willman, C., Petsev, D., Evans, D., Parikh, A., Chackerian, B., Wharton, W., Peabody, D., & Brinker, C. (2011). The targeted delivery of multicomponent cargos to cancer cells by nanoporous particle-supported lipid bilayers Nature Materials DOI: 10.1038/nmat2992
Irvine, D. (2011). Drug delivery: One nanoparticle, one kill Nature Materials DOI: 10.1038/nmat3014
Vía | Sandia National Laboratories.






0 comentarios:
Publicar un comentario
Se respetuoso con tus comentarios y críticas. Cualquier comentario ofensivo será eliminado.